利用表格数据分析合金组成的中考计算题解析
有关合金成分判断的计算试题在中考中多有出现,其中,以实验数据测定为情境的表格分析题,综合性强,难度较大。在该类试题中,往往糅合了对金属性质的考查,有关溶液计算的考查,有关化学方程式计的考查算等多方面化学知识。解答这样的试题,需要学生有很强的数据分析能力,逻辑推理能力。在解题过程中,使学生认识和体验数据分析和定量计算在化学中的作用和意义。
面对此类试题,学生往往无从下手,不知所措,主要的问题体现在学生对反应原理不够清楚,不会用简单的计算方法分析表格中的数据,不能正确解读表格中数据所包含的信息。笔者遴选2010年各地中考试题中的几个相关试题,加以归类并简要分析,希望能帮助学生有效的解答类似试题。
一、对铜锌合金组成的分析
【例题1】2010湖南娄底中考第31题
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
|
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) |
| 第1次 | 20 | 17.4 |
| 第2次 | 20 | 14.8 |
| 第3次 | 20 | 12.2 |
| 第4次 | 20 | 12.0 |
| 第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为 ;
(2)黄铜样品中锌的质量分数为 ;
(3)所用稀硫酸中硫酸的质量分数是多少? 。
【解析】根据金属活动性,黄铜中只有锌能与稀硫酸发生反应,铜不和稀硫酸反应。表格中的数据显示,共进行5次实验,每次所使用的稀硫酸均为20g,黄铜样品的质量为20g,在第一、二、三次实验中,每加20g稀硫酸,固体质量均减少2.6g,说明20g溶液中的硫酸与2.6g锌恰好完全反应。当第四次加入20g稀硫酸时,若硫酸反应完全,固体也应减少2.6g,但实际减少的为12.2g-12.0g=0.2g,小于2.6g,说明硫酸过量,样品中的锌已经完全反应,剩余的固体应为铜,且质量为12.0g。则第五次再加入硫酸时,剩余固体只有铜,质量不会减少,所以m=12.0g。样品中锌的质量为20g - 12.0g = 8.0g。则锌的质量分数为:8.0g/20.0g×100% = 40%。若要计算所用稀硫酸的质量,则取用的硫酸中的溶质应完全反应,根据对上述表格数据的分析,在第一、二、三次实验中硫酸完全反应,可用于计算。如下述过程所示:
解:设所用稀硫酸中硫酸的质量分数为x,据题意得:
Zn + H2SO4 = ZnSO4 + H2↑
65 98
20g-17.4g 20g×x
65/2.6g = 98/(20g×x)
x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
【参考答案】(1)12.0(或12) (2)40% (3)19.6%
【例题2】2010浙江宁波中考第37题
为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
|
| 第1次 | 第2次 | 第3次 | 第4次 |
| 加人稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
 (1)第2次测得剩余固体质量为74g,其成分为 。
(1)第2次测得剩余固体质量为74g,其成分为 。
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌: 。
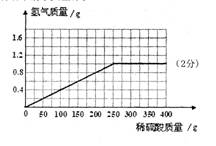
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图。
【解析】根据表格数据,每次使用稀硫酸的质量相同,由第1、2组数据分析,每加100g稀硫酸,固体质量减少13g,当第3次加入稀硫酸时,固体减少了74g – 67.5g = 6.5g,小于13g,说明在第2次加入硫酸剩余的固体中还含有锌,铜不和稀硫酸反应,并且在第3次实验中稀硫酸是过量的,金属锌已经完全反应,剩余铜的的质量为67.5g,则锌的质量为100.0g – 67.5g = 32.5g, m铜:m锌为67.5:32.5 = 27:13。第1、2次实验中硫酸完全反应,可用于计算稀硫酸的溶质质量分数。
解:设参加反应的H2SO4的质量为x
 反应的锌的质量为100 g–87 g = 13 g
反应的锌的质量为100 g–87 g = 13 g
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g x
65/98 = 13g/x,
x=19.6 g
19.6 g/100 g×100% =19.6%
答:所用稀硫酸中溶质质量分数为19.6%
根据数据可得每反应13 g锌消耗100 g稀硫酸,则合金中共32.5 g锌,完全反应共消耗稀硫酸250 g,并最多生成氢气1.0 g,可据此绘图(如图示)。
【参考答案】(1)C (2)27:13 (3)19.6%
二、对铁碳合金组成的分析
【例题3】2010四川乐山中考第47题
生铁是铁和碳的合金。为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应)。测得的实验数据如下:
|
| 反应前 | 反应后 |
| 烧杯及其中物质的质量 | 97.0g | 96.8g |
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
【解析】反应加入物质的总质量为97.0g,铁与稀硫酸反应生氢气使得物质质量减少,则反应生成的氢气质量=97g—96.8g=0.2g。再根据化学方程式,计算样品中铁的质量和反应后硫酸亚铁的质量。过程如下:
解:设生铁中铁的质量为x,生成硫酸亚铁质量为y,则
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
x y 0.2g
x=0.2g×56/2=5.6g
y=0.2g×152/2=15.2g
Fe%=5.6g/6g×100%=93.3%
反应后溶液的总质量为 65.0g + 5.6g -0.2g = 70.4g
则: FeSO4%=15.2g/70.4g×100% = 21.6%
【参考答案】(1)0.2g (2)93.3% (3)21.6%
三、对合金中金属种类的确定
【例题4】2010广东茂名中考第19题
某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0g放入烧杯中,然后将56.0g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分.实验数据记录如下表:
| 编号 | 1 | 2 | 3 | 4 |
| 加入硫酸的质量/g | 14 | 14 | 14 | 14 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 6.0 |
试求:
(1)该合金中铜的质量分数是 。
(2)该合金除铜外,另一种金属是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)
【解析】铜不与稀硫酸反应,根据表格中的数据,每次加入的硫酸的质量均为14g,实验1,2,3中剩余固体质量均比上一次减少1.3g,第4次实验中剩余固体的质量比第3次减少6.1g - 6.0g = 0.1g,说明在第4次实验中硫酸是过量的,金属完全反应,只剩下铜,则铜的质量为6.0g,其质量分数为:6.0g/10.0g×100% =60.0%。欲判断M金属是何种金属,计算步骤如下:
解:设M金属的相对原子质量为x
M + H2SO4 = MSO4 + H2↑
x 98
10.0 g-6.1 g 42.0g×14.0%
x:98=(10.0g-6.1g):42.0g×14.0%
得:x=65
所以M是锌,即合金中另一种金属为锌。
第3次中硫酸完全反应,可设第三次实验所生成硫酸锌质量为y,生成氢气质量为z
Zn + H2SO4 = ZnSO4 + H2↑
98 161 2
42.0g×14.0% y z
98:161=42.0g×14.0%:y 42.0g×14.0%:2 = 42.0g×14.0%:z
y=9.66g z=0.12g
所以反应后,硫酸锌的质量分数为9.66g÷(42g+3.9g-0.12g)×100%=21.1%
【参考答案】(1)60.0%,(2)M是锌,(3)21.1%
根据以上分析,对于此类试题的解答,一是要掌握反应原理,熟练应用金属的活动性顺序,正确判断可能发生的反应。二是提高数据分析能力,要会比较相同的数据,体会相同数据代表的意义;要会比较相邻的数据,特别是相邻数据差异的原因要弄清。第三,在解题过程中还要关注解题格式规范,不能随心所欲,要细致书写,力求准确完整。
| 中考政策 | 中考状元 | 中考饮食 | 中考备考辅导 | 中考复习资料 |