高考选了化学的朋友们注意了,小编汇整了高考化学考试必考知识点,为方便您对高考化学考试内容的全面了解,小编从高考化学的考核目标与要求、高考化学的必考知识点和高考化学的选考知识点三个层次来说明此次高考化学大考点内容及考核目标和要求,预祝您考试顺利!!!
高考化学的必考知识点
必考内容涵盖必修模块"化学1""化学2"和选修模块"化学反B应原理"的内容。根据化学的学科体系和学科特点,必考部分的内容包括:化学学科特点和基本研究方法、化学基本概念和基本理论、常见无机物及其应用、常见有机物及其应用和化学实验基础五个方面。
1.化学学科特点和基本研究方法
(1)了解化学的主要特点是在原子、分子水平上认识物质。了解化学可以识别、改变
和创造分子。
(2)了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。认识
化学是以实验为基础的一门科学。
(3)了解物质的组成、结构和性质的关系。了解化学反应的本质、基本原理以及能量
变化等规律。
(4)了解定量研究方法是化学发展为一门科学的重要标志。了解化学与生活、材料、能源、环境、生命、信息技术等的关系。了解"绿色化学"的重要性。
2.化学基本概念和基本理论
(1)物质的组成、性质和分类
了解分子、原子、离子和原子团等概念的含义。
理解物理变化与化学变化的区别与联系。
理解混合物和纯净物、单质和化合物、金属和非金属的概念。
理解酸、碱、盐、氧化物的概念及其相互联系。
(2)化学用语及常用物理量
熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价。
掌握原子结构示意图、电子式、分子式、结构式和结构简式等表示方法。
了解相对原子质量、相对分子质量的定义,并能进行有关计算。
理解质量守恒定律。
能正确书写化学方程式和离子方程式,并能进行有关计算。
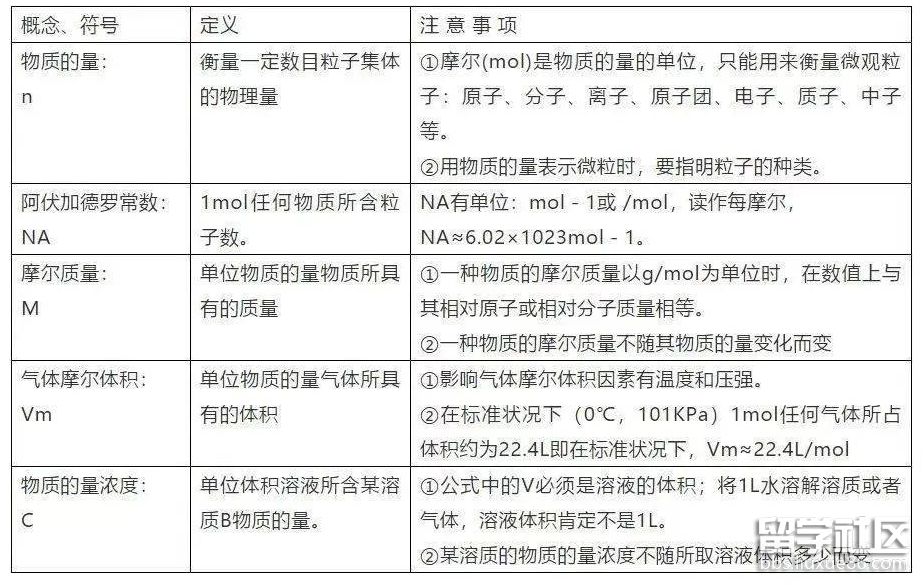
了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、
物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
(3)溶液
了解溶液的含义。
了解溶解度、饱和溶液的概念。
了解溶液浓度的表示方法。理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
了解胶体是一种常见的分散系,了解溶液和胶体的区别。
(4)物质结构和元素周期律
了解元素、核素和同位素的含义。
了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
了解原子核外电子排布规律。
...