现如今高考备考已经进行一段时间了,为了帮助考生更好的备考,下面由出国留学网小编为你精心准备了“高考近五年化学常见考点”,持续关注本站将可以持续获取高考资讯!
高考近五年化学常见考点
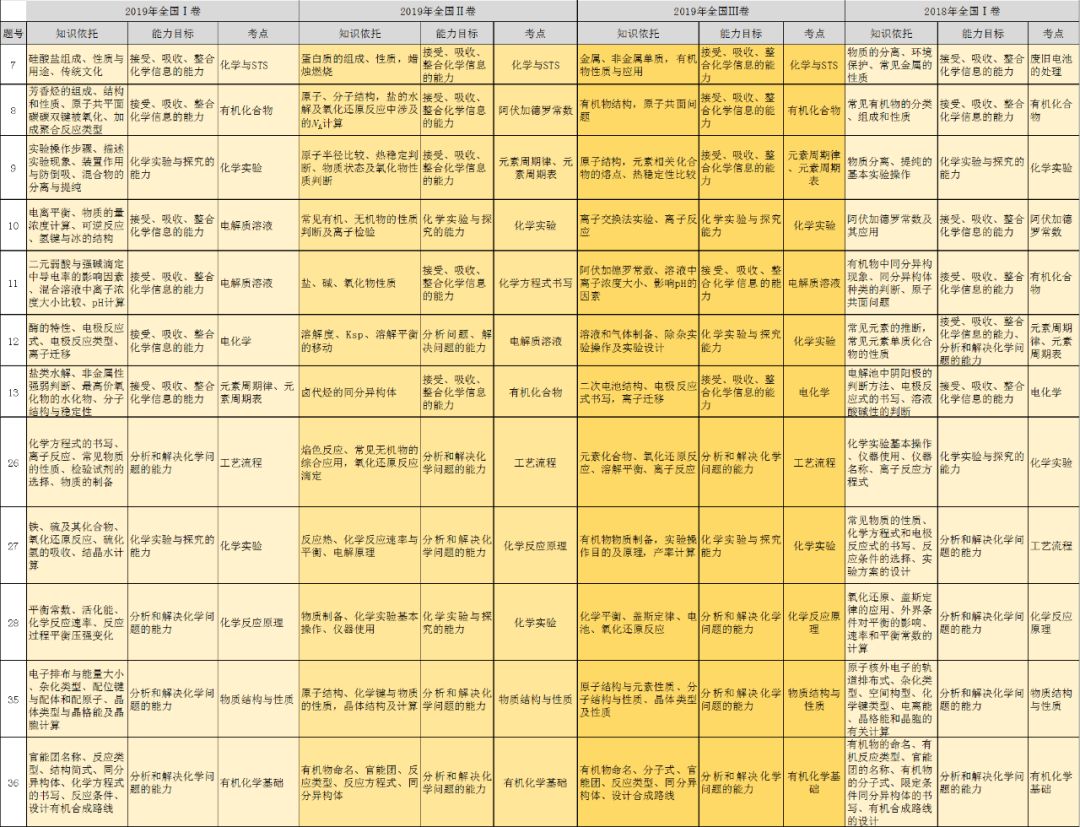
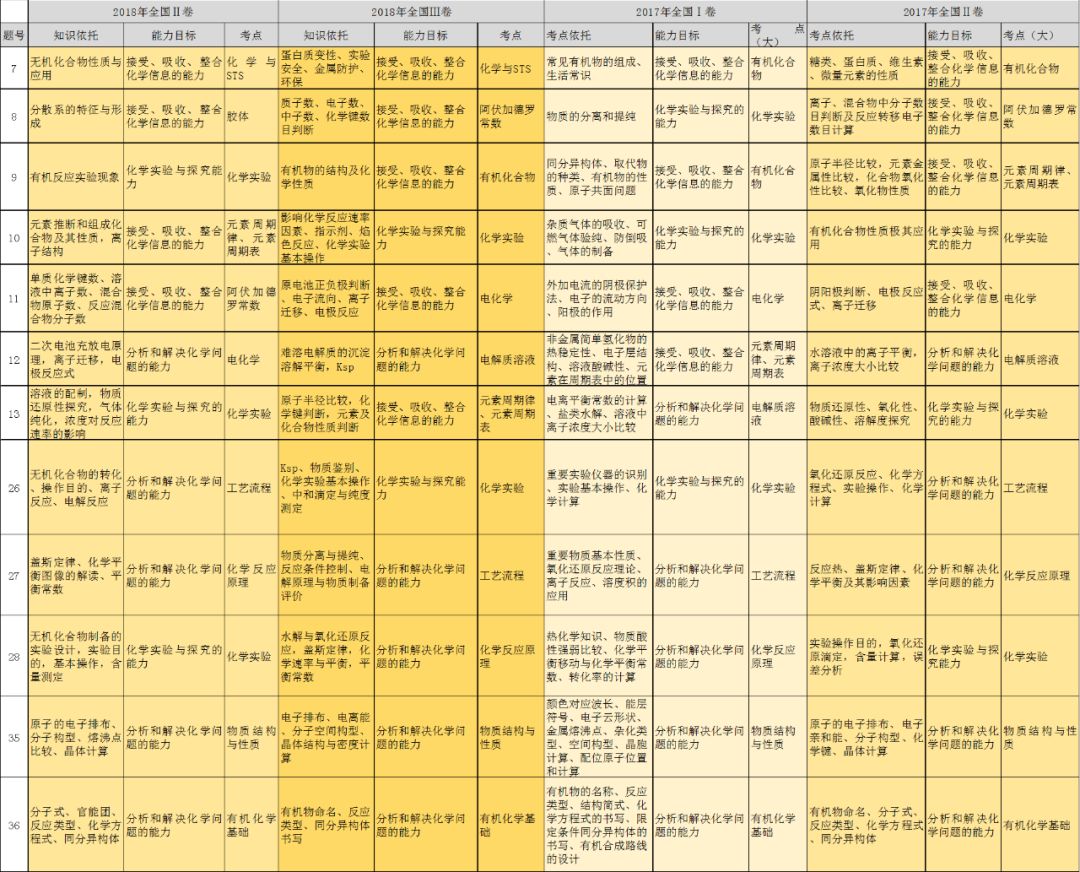
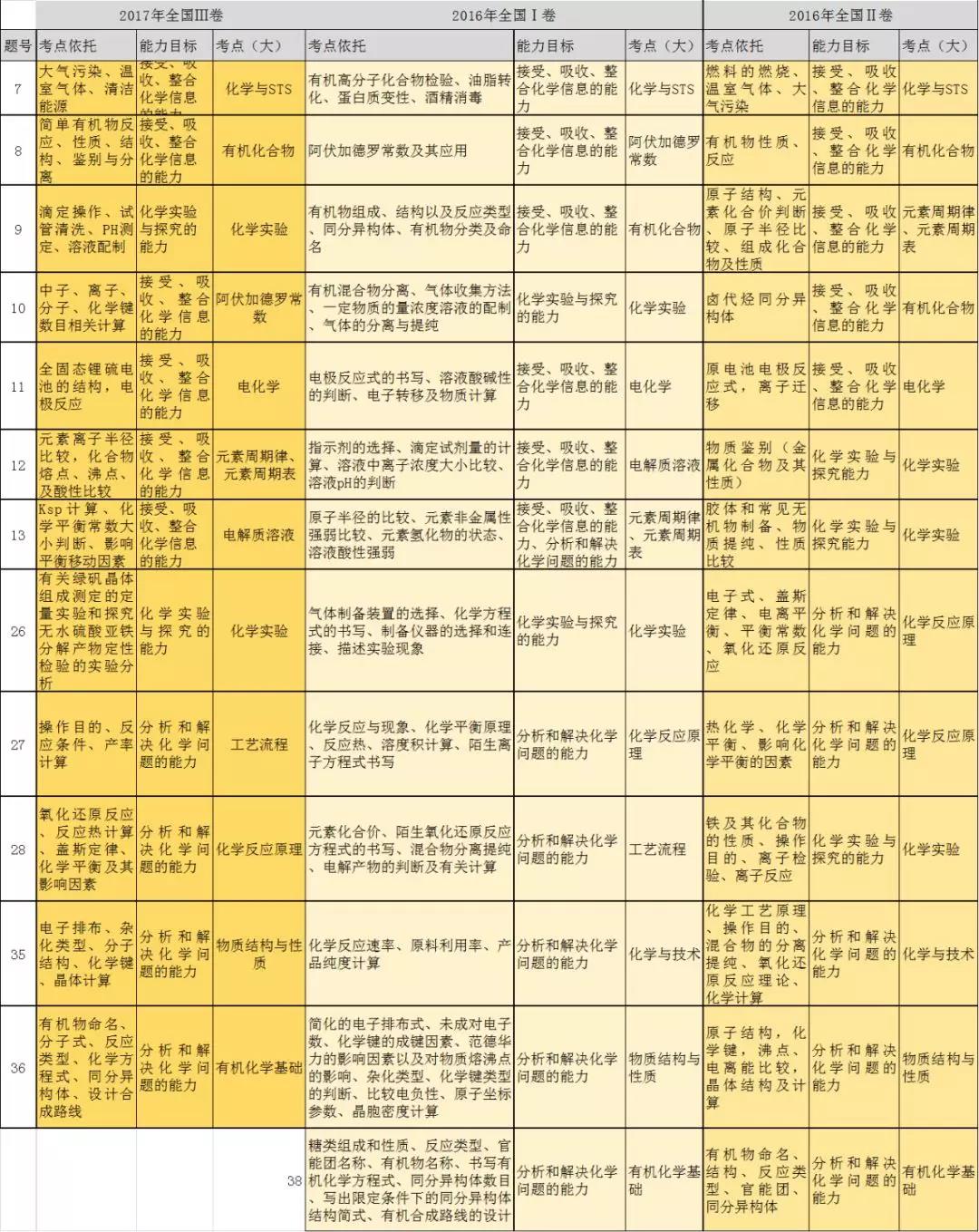
高考化学常考高频重点
《化学2》必修
第一章:物质结构、元素周期律
第一节:元素周期表第二节:元素周期律(重点,难点)第三节:化学键
分析:这章的学习重难点是根据元素周期律推断某元素的金属性,非金属性的强弱,会比较元素间氧化能力,还原能力强弱。
第二章:化学反应与能量
第一节:化学能与热能第二节:化学能与电能(重点,难点)第三节:化学反应的速率和限度(重点,难点)
分析:本章的所有知识点都是高考的一个重点和难点,第1节“化学能与热能”会为高二选修4中“化学反应的热效应”做好铺垫,环环相扣。第2节“化学能与电能”学生将学习到“原电池”,在学习这块的时候主要是要知道发生反应的条件,并且各级发生什么反应,怎样写电极反应式。这将会为高二选修4中“电化学基础”的学习做好铺垫。掌握理解影响反应速率的因素,并且会判断改变反应条件后反应的移动方向,为高二选修4中“化学反应速率和化学平衡”做好铺垫。
第三章:有机化合物
第一节:最简单的有机化合物——甲烷(重点)第二节:来自石油和煤的两...